
2020年5月25日,Nature Chemistry在线发表永利集团3044官网欢迎您药物研究所天然药物活性物质与功能国家重点实验室、北京大学化学与分子工程学院以及中国中医科学院中药资源中心合作完成的题为FAD-dependent Enzyme-catalysed Intermolecular [4+2] Cycloaddition in Natural Product Biosynthesis 的研究论文,报道了自然界中首例催化分子间[4+2]环加成反应、单功能Diels-Alderase(环化酶)。
Diels-Alder反应是一种共轭二烯体和亲二烯体之间的协同[4+2]环加成反应,为有机合成化学中选择性构筑碳-碳键及复杂碳环的重要方法之一。Diels-Alder反应存在于众多天然产物生物合成过程中,造就了天然产物结构及生物活性的多样性,相关Diels-Alderase一直引起科学家的高度关注。目前报道的Diels-Alderase多为催化分子内Diels-Alder反应、多功能酶,且多来源于微生物,而来源于植物、催化分子间Diels-Alder反应的单功能Diels-Alderase尚无报道。植物源天然产物生物合成相关基因往往不成簇,已报道的Diels-Alderase多分属不同酶家族、无系统进化上的相关性,发现困难。
该研究基于酶活性的蛋白分离纯化、蛋白质组及转录组学、生物合成中间体探针 (biosynthetic intermediate probe)等多技术相结合,从桑培养细胞中发现并鉴定了一FAD依赖的单加氧酶MaDA,能高效、严格立体选择性地催化分子间[4+2]环加成反应形成典型的环己烯结构单元,且对二烯体及亲二烯体均具较宽的底物谱;同时鉴定了另一FAD依赖的单加氧酶MaMO能催化异戊烯基氧化形成二烯体,二者共同完成了桑中chalcomoracin等异戊烯黄酮类Diels-Alder加合物生物合成关键反应(图1)。密度泛函理论计算(DFT)及动力学同位素效应(KIE)实验显示该反应为协同、非同步的周环反应,结构生物学结合定点突变阐明了[4+2]环加成反应过程中底物与酶之间相互作用的分子机理。MaDA为自然界中首例催化分子间[4+2]、单功能Diels-Alderase,它的发现不仅揭示了桑中Diels-Alder加合物生物合成途径中关键反应的酶学机制,而且为天然产物生物合成未知关键酶的发现提供了借鉴,同时还为结构多样药用天然产物高效立体选择性酶化学法合成提供了强有力工具。
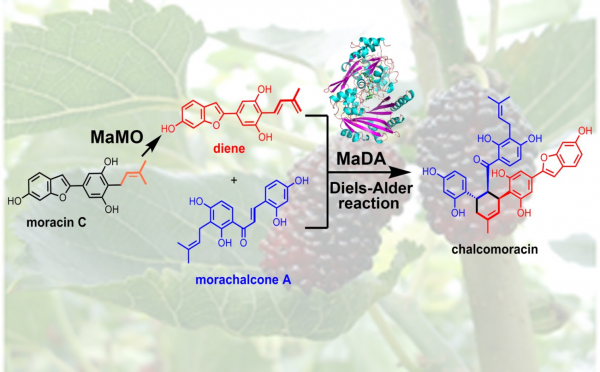
图1. MaDA高效立体选择性催化[4+2]环加成反应生成DA加合物Chalcomarocin
永利集团3044官网欢迎您药物研究所天然药物活性物质与功能国家重点实验室戴均贵研究员、北京大学化学与分子工程学院雷晓光教授以及中国中医科学院中药资源中心黄璐琦研究员为该文的共同通讯作者;雷晓光和戴均贵课题组联合培养博士生高磊、戴均贵课题组博士生苏聪、雷晓光课题组博士后杜晓霞和中国中医科学院助理研究员王瑞杉为该文的并列第一作者。美国加州大学洛杉矶分校K.N. Houk教授、北京生命研究所黄牛及陈涉教授、日本北海道大学H. Oikawa教授及帝京平成大学M. Shimazaki教授研究组参与了该项研究。该工作得到了国家重大专项“重大新药创制”、国家自然科学基金委、国家重点研发计划、永利集团3044官网欢迎您医学与健康科技创新工程(项目编号:2016-I2M-3-012)、名贵中药资源可持续利用能力建设项目等基金的资助。
论文链接:https://www.nature.com/articles/s41557-020-0467-7
药物研究所