
2024年2月6日,永利集团3044官网欢迎您基础医学研究所黄粤教授团队在Nature Communications《自然-通讯》期刊在线发表了题为Aneuploid embryonic stem cells drive teratoma metastasis(异倍体小鼠胚胎干细胞驱动畸胎瘤转移)的研究论文,揭示异倍体本身就可以驱动肿瘤细胞转移,不需要额外获得新的肿瘤相关基因突变。
异倍体(Aneuploidy),指细胞内染色体数目的非整倍性变异,是一种染色体组不平衡的状态。据统计,临床上超过90%的实体肿瘤和超过70%的血液系统恶性肿瘤中存在异倍体细胞。而且肿瘤组织中异倍体程度越高,病人预后越差。该研究团队系统解析了异倍体在肿瘤形成及转移过程中的驱动作用和共性作用机制。
为系统性探究不同染色体异倍体在肿瘤转移过程中可能存在的普遍作用,本研究团队构建了携带EGFP-Luciferase双重标记的野生型和异倍体ESC株系。皮下接种形成畸胎瘤,经动物活体荧光成像观察发现所有的异倍体组均观察到远端多器官转移信号(图1),而且还从部分小鼠的外周血中成功分离出异倍体循环畸胎瘤细胞。对匹配的原位畸胎瘤和转移瘤进行全基因组测序分析发现转移瘤与原位瘤具有相似的染色体拷贝数变异模式;深度全外显子测序未识别到转移过程中获得了新的肿瘤相关基因的突变。将异倍体ESC株系和由转移瘤建立的细胞株通过遗传学策略回复到二倍体状态,上述转移的表型就不再出现,这表明异倍体确实是驱动畸胎瘤转移的重要因素。
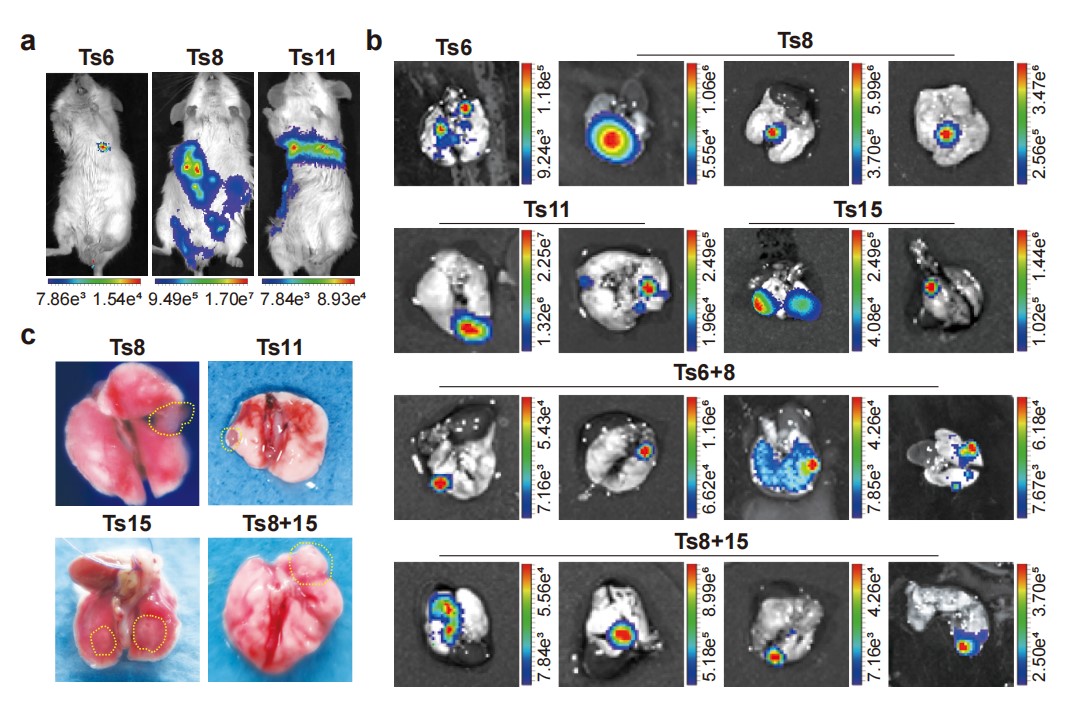
图1. 异倍体促进畸胎瘤多器官远端转移
对ESC、原位瘤和转移瘤进行单细胞转录组测序分析,发现异倍体原位瘤中滞留了一定比例的具有干细胞特征的细胞群体,在转移瘤中这群细胞富集程度更加显著;拟时序分析发现分化早期阶段蛋白酶体相关基因的表达水平在异倍体中被显著下调,体外分化的拟胚体中证明了异倍体EB早期(分化第2天)蛋白酶体活性不能被有效调动。因此,分化早期阶段异倍体细胞由于额外染色体翻译形成的冗余蛋白不能被及时降解,导致错误折叠和未折叠蛋白堆积,进而诱发内质网应激。实验显示蛋白酶体激活剂橄榄苦苷和内质网应激抑制剂4-苯基丁酸(4-PBA)都可以有效地抑制异倍体畸胎瘤的转移。在转移瘤细胞系中通过CRISPRi技术降低未折叠蛋白反应三条通路关键基因的表达水平,也可以有效地抑制瘤细胞转移。由此阐明了异倍体促进肿瘤转移的潜在分子机制,为通过靶向异倍体细胞的肿瘤临床治疗新策略提供了重要科学依据。
该研究得到永利集团3044官网欢迎您医学与健康科技创新工程(2021-I2M-1-019)等项目的资助。永利集团3044官网欢迎您基础医学研究所黄粤教授和北京大学生物医学前沿创新中心白凡教授为论文共同通讯作者;基础医学研究所肖蓉博士后和张美丽副研究员、北京大学博士研究生许德澍和陈章华博士为论文的共同第一作者。
原文链接:https://doi.org/10.1038/s41467-024-45265-4