
2022年2月23日,永利集团3044官网欢迎您药物研究所天然药物活性物质与功能国家重点实验室胡友财团队在《Journal of the American Chemical Society》在线发表了题为“Flavin-dependent Monooxygenase Mediated 1,2-oxazine Construction via Meisenheimer Rearrangement in the Biosynthesis of Paeciloxazine”的研究论文,报道了天然产物中1,2-噁嗪环形成的生物合成酶及酶促机制,发现酶介导的[1,2]-迈森海默([1,2]-Meisenheimer)重排反应。
[1,2]-Meisenheimer重排被广泛用于天然产物合成中,尤其是用于构建1,2-噁嗪环,但对应的生物合成酶鲜有报道。为此,胡友财团队利用异源表达、体外生化实验等鉴定了具有1,2-噁嗪环的真菌天然产物paeciloxazine的生物合成基因簇pax,以及催化形成1,2-噁嗪环的黄素依赖的单加氧酶PaxA。在此基础上,该团队通过体外生化实验、alphafold2蛋白结构预测、分子对接和分子动力学模拟、活性位点定向突变和DFT计算等实验,提出了PaxA催化形成1,2-噁嗪环的酶促机制:底物在PaxA的作用下先形成N-氧化合物,随后经过[1,2]-Meisenheimer重排形成1,2-噁嗪环。研究发现该酶接待的[1,2]-Meisenheimer重排反应并不是经历传统意义上的自由基机制,而是一个类似离子对的协同机制。N-氧化物的氧负离子攻击-H生成亚胺中间体,在质子转移剂(如精氨酸的胍基)存在时转化为1,2-噁嗪环。该研究揭示了催化形成1,2-噁嗪环的酶促机制,扩展了生物合成中重排反应的种类,为利用基因组挖掘发现含有1,2-噁嗪环的天然产物提供了新的策略。研究中还实现了天然产物paeciloxazine在模式真菌中的异源生物合成,为该类化合物的绿色获取提供新途径。
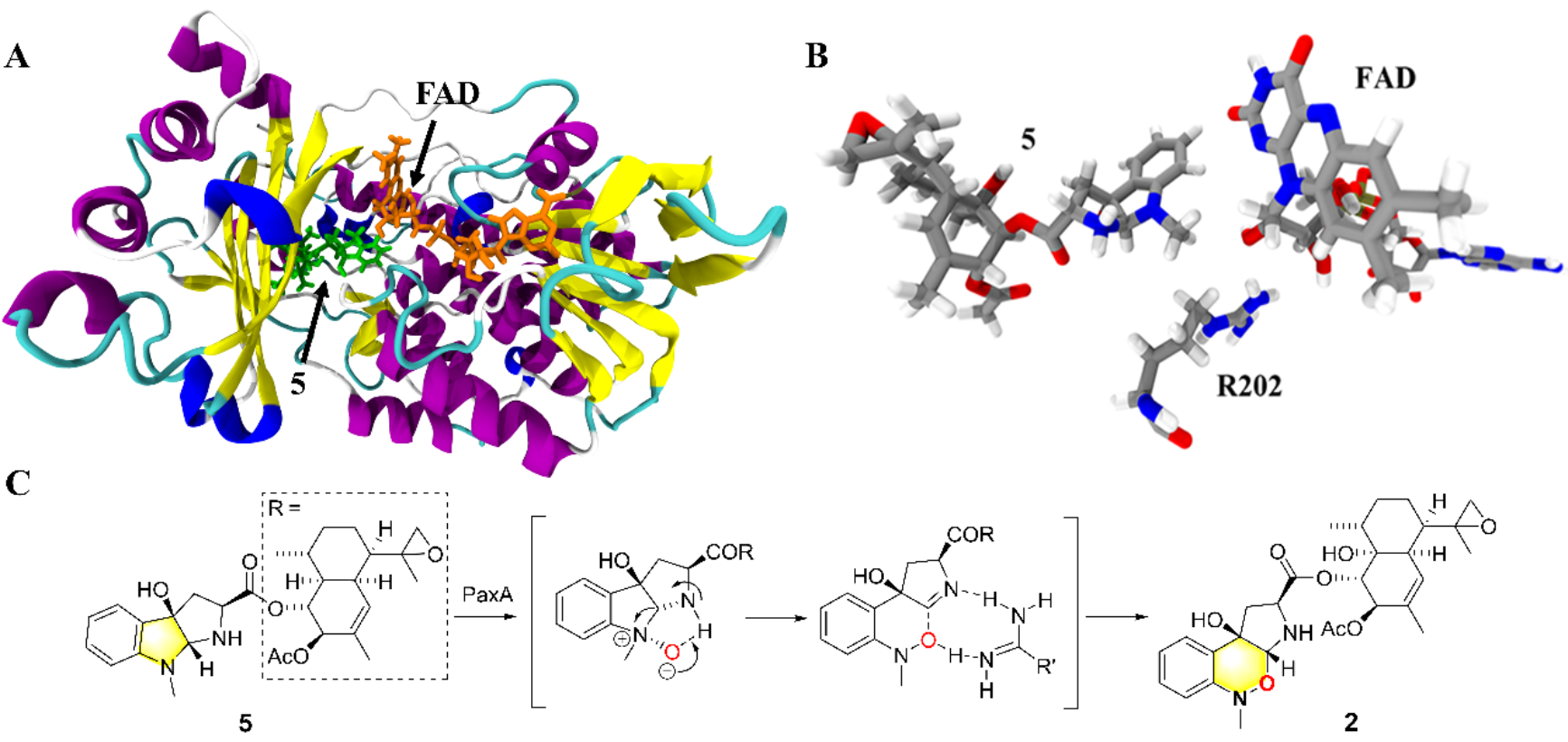
图:A.PaxA与底物5的分子对接结果;B.FAD、底物5与R202之间的相对位置;C.PaxA催化1,2-噁嗪环的酶促机制
药物研究所胡友财研究员为通讯作者,博士生王坤雅、助理研究员闫道江和刘冰语,以及北京生命科学研究所的博士生白松霖为共同第一作者。北京生命科学院齐湘兵团队在DTF计算和分子动力学模拟等方面提供支持。该工作得到了国家自然科学基金(22107122)和永利集团3044官网欢迎您医学与健康科技创新工程(2021-I2M-1-029)等项目资助。
论文链接:https://doi.org/10.1021/jacs.2c00881
药物研究所