
2023年9月21日,永利集团3044官网欢迎您基础医学研究所张卫奇团队与许海燕团队合作在ACS Materials Letters《美国化学学会材料快报》期刊上发表了题为“Radiotherapy potentiates the P-selectin targeted cancer drug delivery based on a cisplatin and mitoxantrone co-assembled fucoidan nanogel”(放疗增效顺铂与米托蒽醌共组装的岩藻多糖纳米凝胶的P-选择素靶向肿瘤药物递送)的研究性论文,并被选为当期封面论文(CoverArticle)(图1)。该研究报道了一种将岩藻多糖(Fucoidan, Fuc)、化疗药物顺铂(Cisplatin, Cis)和米托蒽醌(Mitoxantrone, Mito)共组装制备的载药纳米凝胶FCM,进一步联合放疗在小鼠乳腺癌模型中实现了P-选择素靶向药物递送的增效。
靶向纳米药物针对肿瘤的药物递送过程中,其治疗效果在很大程度上取决于纳米药物与肿瘤特异性受体之间的特异性识别。目前,在设计靶向药物递送载体时,作为靶标的肿瘤特异性受体的选择仍十分有限。因此,利用肿瘤新生抗原(Neoantigen,如:肿瘤中新形成或过表达的细胞受体)以区分肿瘤细胞与正常细胞,进而引导纳米药物靶向递送至肿瘤细胞,在增强抑瘤效果和生物安全性等领域具有重要的应用前景。P-选择素是一种负责白细胞募集和血小板结合的黏附分子,在部分肿瘤组织中过表达。研究报道表明,电离辐射(放疗)可上调P-选择素在肿瘤细胞和内皮细胞中的表达,这为指导肿瘤药物递送提供了靶点。岩藻多糖(Fuc)是一种天然多糖,对P-选择素有高亲和力,具备良好的生物相容性和独特的生物活性,已被广泛应用于食品和药品行业。

图1载药纳米凝胶FCM的抗肿瘤应用(杂志封面图)。
在该工作中,本研究团队巧妙地利用岩藻多糖(Fuc)和两种化疗药物:顺铂(Cis)和米托蒽醌(Mito)之间的分子自组装,成功构建了FCM纳米凝胶(图2),在对其物理化学性质进行表征后,并系统评价了FCM在体内外的治疗效果。研究结果表明,在细胞水平上,放疗可以上调小鼠乳腺癌细胞4T1和人脐静脉内皮细胞HUVEC表面P-选择素的表达水平,同时伴随着细胞对FCM摄入的增加。此外,辐照预处理可增强FCM的细胞毒性。在小鼠乳腺癌模型中,对肿瘤部位进行局部辐照预处理可诱导肿瘤P-选择素的上调,从而进一步增效FCM的靶向递送,提高其抗肿瘤效应。此外,与给药游离的顺铂与米托蒽醌相比,FCM可以显著降低其系统毒性。本研究中的FCM通过岩藻多糖介导的P-选择素靶向联合放疗的应用,可高效实现肿瘤的靶向药物共递送,为提高药物的肿瘤靶向递送效率提供了一种简易和低成本的策略。
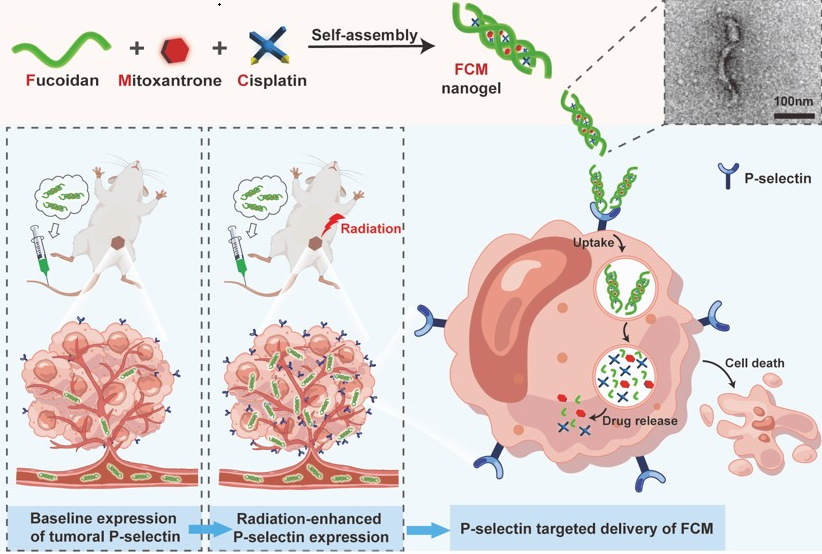
图2. FCM纳米凝胶的制备及作用机制示意图。
此研究工作得到北京市科技新星计划(Z201100006820110,Z211100002121016)、细胞生态海河实验室创新基金(22HHXBSS00040)和永利集团3044官网欢迎您医学与健康科技创新工程(CIFMS 2021-I2M-1-006)的资助。基础医学研究所张卫奇副研究员和许海燕研究员为论文通讯作者,23年硕士毕业生王慧敏为论文第一作者。
论文链接:https://pubs.acs.org/doi/10.1021/acsmaterialslett.3c00747