
2023年12月20日,永利集团3044官网欢迎您基础医学研究所暨永利集团3044官网欢迎您免疫治疗研究中心曹雪涛院士团队在Nature Communications《自然通讯》在线发表题为“Nuclear RPSA senses viral nucleic acids to promote the innate inflammatory response”(核内RPSA通过识别病毒核酸促进天然炎症反应)的研究论文,寻找到细胞核内重要的识别病毒核酸并调控炎症反应的分子,为我们探索宿主抗病毒作用及其方式提供了新的思路。
宿主细胞表达各种固有感受器来识别病毒核酸,从而触发固有信号级联。据报道,细胞质中的一些固有感受器识别病毒核酸后,通过联合启动I型干扰素(IFN-I)和促炎细胞因子的表达来激活固有免疫应答。一些核酸传感器,如cGAS和RIG-I,也被发现易位到细胞核中,启动针对病毒感染的固有免疫反应。在之前的研究中,研究人员报道了核不均一核糖核蛋白A2/B1(hnRNPA2B1)作为一种核DNA感受器,在DNA病毒感染后诱导IFN-I的反应。然而,病毒核酸是否以及如何在细胞核内被识别,从而选择性地诱导促炎细胞因子基因的转录,从而增强抗病毒固有应答仍是很大程度上未知的。
本研究通过利用小RNA干扰文库对与团队前期捕获的HSV-1 DNA直接结合的细胞核蛋白进行功能筛选,发现了可以在细胞核内直接识别病毒核酸并促进炎症因子表达的蛋白分子40S核糖体蛋白SA(RPSA)。Rpsa髓系特异性缺陷小鼠对在细胞核内进行复制的病毒如单纯疱疹病毒-1(HSV-1)和甲型流感病毒(IAV)的感染表现出较少的先天炎症反应。机制上,核定位的RPSA在感染后Tyr204位点磷酸化,然后招募ISWI复合体催化亚基SMARCA5来增加NF-κB对靶基因启动子的染色质可及性,而不影响先天信号传导(见图1)。本课题发现了核糖体蛋白RPSA可以通过与染色质重塑复合体SMARCA5相互作用,直接增加染色质开放水平,但不影响炎症信号通路活化,而促进炎症因子表达的新型天然免疫机制,并且验证了RPSA在小鼠体内促进病毒感染后炎性细胞因子表达但不影响干扰素表达,揭示了核糖体蛋白的全新天然免疫功能,提出了核糖体蛋白调控翻译以外的新的抗病毒机制。
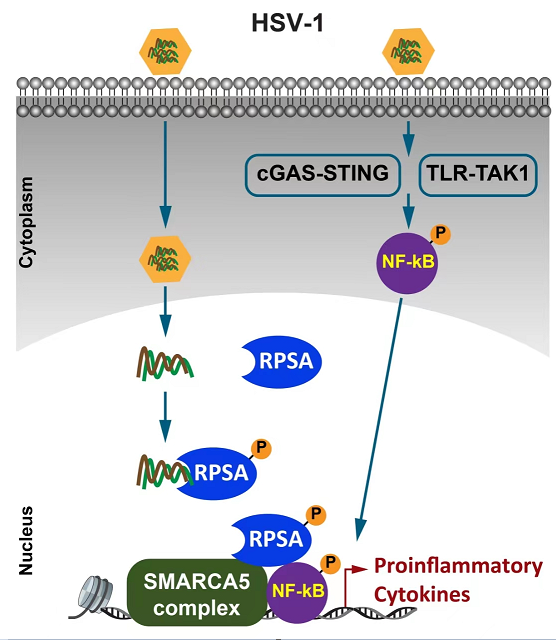
图1.RPSA响应核内病毒感染促进促炎细胞因子转录的模式图。
总之,本研究揭示了细胞核内核糖体蛋白的新功能,通过与染色质重塑复合体相互作用而直接参与调控基因的转录,为我们理解核糖体蛋白在病毒与宿主相互作用以及病毒感染触发天然免疫过程中的功能提供了新的认识;此外提出了由细胞核内病毒DNA引发炎症的新思路,为病原性核酸诱导的炎症或炎症相关自身免疫病的研究与防治提供了潜在新靶点和探索方向。
本研究工作得到国家自然科学基金基础科学中心项目(82388201)和永利集团3044官网欢迎您医学与健康科技创新工程(2021-I2M-1-017)等项目的支持。基础医学研究所曹雪涛院士和南开大学徐贺楠副教授为论文共同通讯作者,基础医学研究所博士蒋龑为论文的第一作者。
论文链接:https://www.nature.com/articles/s41467-023-43784-0#Bib1