
由新型冠状病毒(SARS-CoV-2)感染引起的新冠肺炎(COVID-19)的感染人数和死亡人数还在持续攀升,对全球经济和公共卫生带来前所未有的挑战,目前尚无特效的抗新冠病毒药物,新药物、新靶点的研发势在必行。除病毒自身靶点之外,寻找有效的宿主靶点逐渐成为药物研发的新趋势。冠状病毒不但编码结构蛋白和非结构蛋白,还具有一套独特的“辅助蛋白”。辅助蛋白并非病毒复制必须的蛋白质,但它们对冠状病毒在细胞中的生存至关重要。辅助蛋白参与天然免疫的调节,促进病毒感染。SARS-CoV-2感染的特征之一是IFN-I的诱导被抑制,这归功于辅助蛋白对IFN-I信号通路的干扰。有证据表明:SARS-CoV-2辅助蛋白Orf9b能够与锚定在线粒体膜的多功能接头蛋白TOM70结合,从而抑制抗病毒天然免疫反应。
病原生物学研究所崔胜团队于2021年5月14日在Nature Communications上发表题为《Crystal Structure of SARS-CoV-2 Orf9b in Complex with Human TOM70 Suggests Unusual Virus-Host Interactions》的论文。依赖X射线晶体衍射技术,SARS-CoV-2 Orf9b/TOM70复合物结构的分辨率大幅提升至2.2Å。在高分辨率三维结构的帮助下,研究人员不但更精确地揭示了Orf9b-TOM70相互作用的结构基础,而且发现,SARS-CoV-2 Orf9b通过占据TOM70 CTD口袋改变NTD的构象,从而别构抑制TOM70 NTD与Hsp90蛋白的结合。这些发现有力支持了Orf9b通过结合TOM70干扰Hsp90-TOM70相互作用,最终抑制IFN-1信号通路的假说。
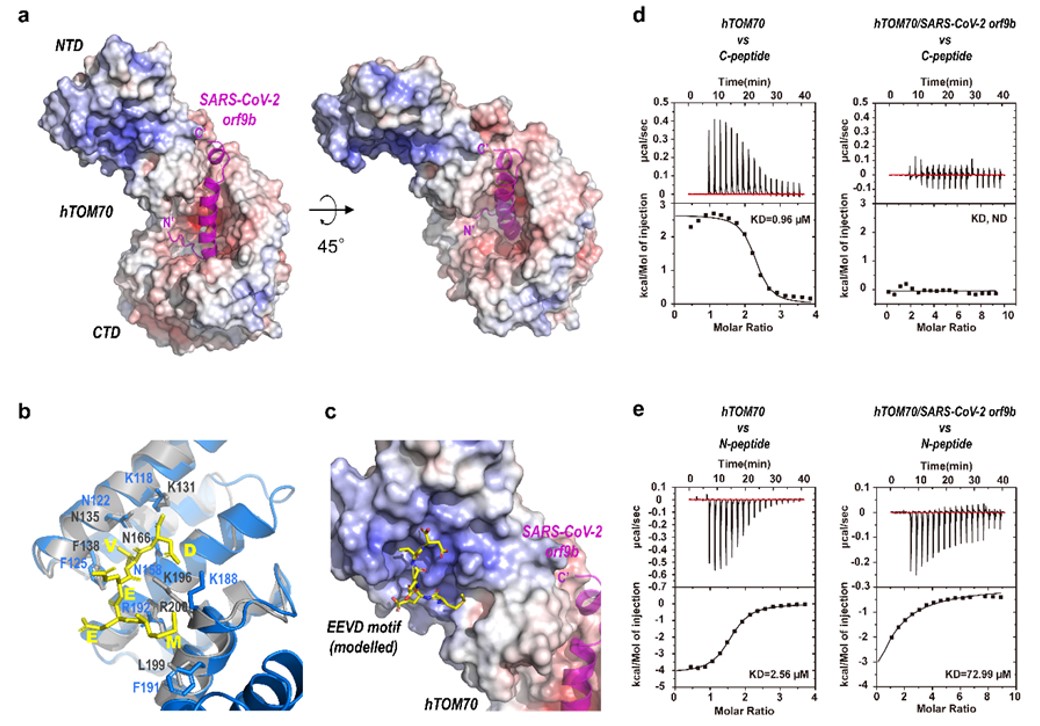
图:SARS-CoV-2辅助蛋白Orf9b与宿主蛋白TOM70的复合物晶体结构
及Orf9b的别构抑制机制
病原所崔胜研究员为本文的通讯作者,崔胜课题组副研究员高小攀博士、博士生朱凯翔和主管技师秦博为本文的共同第一作者。本研究得到永利集团3044官网欢迎您医学与健康科技创新工程(2017-I2M-1-014和2016-I2M-1-013)、国家重点研发专项(2018ZX10101001)等项目的资助。
论文链接:https://www.nature.com/articles/s41467-021-23118-8
文图|病原生物学研究所