
2022年7月7日,永利集团3044官网欢迎您药物研究所天然药物活性物质与功能国家重点实验室蒋建东院士、王琰研究员与吉林大学心血管中心佟倩教授合作在国际著名期刊Signal Transduction and Targeted Therapy(信号传导与靶向治疗)在线发表了“Berberine treats atherosclerosis via a vitamine-like effect down-regulating Choline-TMA-TMAO production pathway in gut microbiota”(小檗碱以维生素样作用下调肠道菌胆碱-TMA-TMAO通路而改善动脉粥样硬化症)论文,首次阐明了小檗碱(BBR)以维生素样的作用下调肠道菌胆碱-TMA-TMAO代谢通路而改善动脉粥样硬化症的分子机制。
心血管疾病(CVD)是当前因疾病死亡的首要原因,而动脉粥样硬化(AS)是CVD的病理基础,也是多年来导致CVD发病率不断增加的难治性病变。AS的发病有多种危险因素和分子机制,如高血脂或高血糖、局部或全身炎症反应等。近年来,越来越多的证据表明,肠道菌是AS发展和恶化的影响因素。三甲胺(TMA)是一种肠道菌衍生的代谢产物;肠道菌通过分解摄入的红肉或动物内脏中的膳食磷脂酰胆碱/胆碱、左旋肉碱或甜菜碱而生成。被吸收入血的肠道TMA被黄素单加氧酶家族成员(例如肝脏中的黄素单加氧酶3,FMO3)进一步转化为三甲胺-N-氧化物(TMAO),促进了动脉粥样硬化斑块形成。最新研究表明,与传统的危险因素不同,TMAO是AS的独立预测因子和促进剂。事实上,TMAO通过多种机制加重AS,包括增强对泡沫细胞形成的作用、血小板高反应性和血栓形成风险,直接激活炎症反应和干扰胆固醇的反向转运,因此,抑制肠道菌TMAO的生成被认为是干预AS疾病发生发展潜在的新靶点。
该研究团队首次揭示了AS金黄地鼠口服BBR降低了肠道中TMAO的生物合成。这一独特分子机制是通过小檗碱的代谢产物二氢小檗碱(dhBBR,一种肠道菌NR产生的还原型小檗碱)作用于肠道菌胆碱三甲胺裂解酶及辅酶(CutC/CutD)从而抑制了胆碱向TMA的转化;同时,dhBBR也作用于肠道菌黄素单加氧酶及辅酶(FMO/FAD),使TMA向TMAO转化被抑制,而dhBBR被氧化生成BBR。dhBBR与BBR相互转化,与维生素的作用方式相似(如维生素C与脱氢维生素C),最终下调了胆碱-TMA-TMAO代谢通路而改善动脉粥样硬化。该研究也进一步开展了21个高脂血症伴动脉粥样硬化患者口服BBR的临床试验,结果表明口服BBR四个月后斑块评分减少了3.2% (P < 0.05),其粪便和血中TMA 和TMAO 含量分别降低了38%和29%(粪便:P < 0.05; P < 0.05), 及37%和35%(血: P < 0.001; P < 0.05)。结果证实,BBR可能作用于肠道菌CutC/CutD 及FMO/FAD并以维生素样的作用方式减少肠道菌TMAO的生物合成,从而改善动脉粥样硬化症。本研究首次发现小檗碱通过作用肠道菌NR-CutC/CutD-FMO酶系改善动脉粥样硬化的药效及分子机制,并通过临床试验得到验证。该研究对天然药物(难吸收)体内代谢及分子药理的研究具有广泛的意义和重要的科学价值。
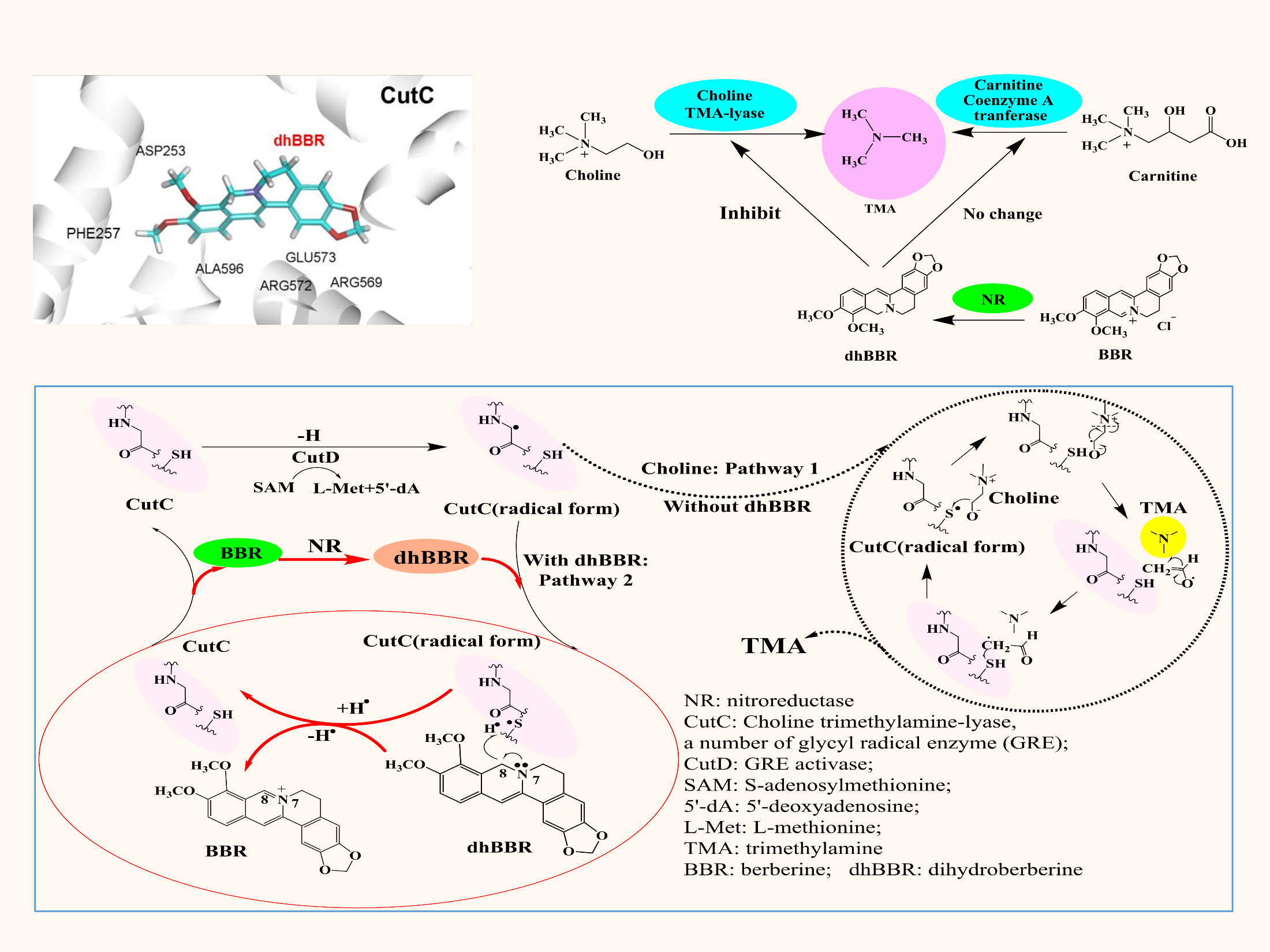
图1 小檗碱代谢物 (dhBBR)抑制肠道菌胆碱TMA裂解酶(CutC)的机制
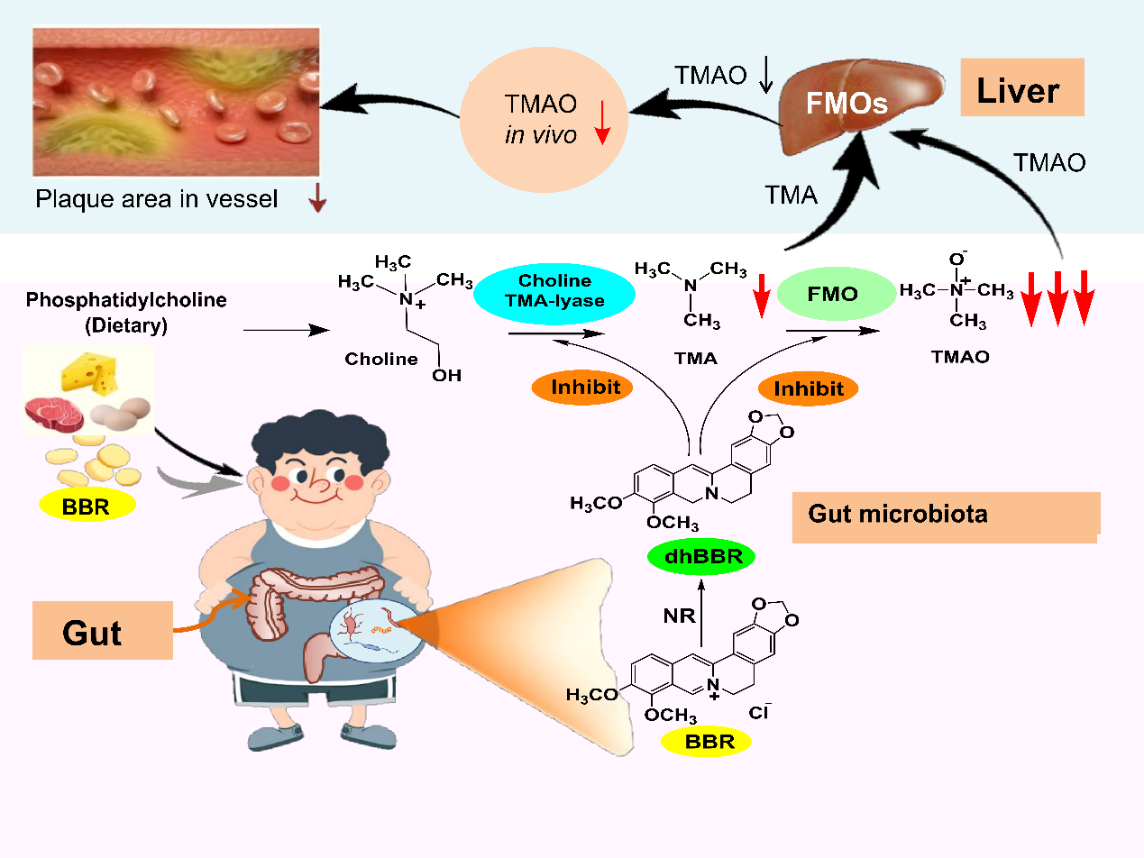
图2小檗碱通过维生素样作用下调肠道菌TMAO的生成而改善动脉粥样硬化症
永利集团3044官网欢迎您医学与健康科技创新工程(2016-I2M-3-011,2021-I2M-1-007)、NSFC(81573493,82173888)和“创新药物非临床药物代谢及PK-PD研究”北京市重点实验室(Z141102004414062)等资助了该研究。药物所蒋建东院士、王琰研究员为通讯作者,药物所博士生马殊荣、吉林大学第一医院心血管中心佟倩教授、药物所林媛副研究员、博士生潘利斌和符洁助理研究员为共同第一作者。
原文链接: https://www.nature.com/articles/s41392-022-01027-6
1